|
Sætistala:
9
Atómmassi:
19
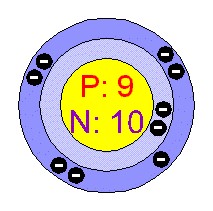
Bygging
atómsins: Flúor eða fluorine hefur 9 rafeindir,
10 nifteindir og hefur 2 hvolf.
Staðsetning
þess í lotukerfinu gefur til kynna að flúor
er í flokki halogenefna. Flúor er gulleitt á
litinn og getur verið hættulegt.
Flúor er virkast allra málmleysingja og bregst
hratt við snertingu á öðrum efnum og þá
yfirleitt með bruna. Járn, gler og jafnvel vatn brennur
við snertingu flúors og efni einsog asbest glóir
ef flúorloft leikur um það.
Efnið
var einangrað árið 1866 af Joseph Henri Moissan.
Fyrstu ábendingar um notkun flúors í einhverri
mynd eru þó frá Georgius Agricola árið
1529. Margar tilraunir voru gerðar af mönnum einsog
Davy, Gay-Lussac, Lavoisier og Thenard áður en loks
tókst að einangra efnið af Moissan og ekki enduðu
allar þessar tilraunir vel.
Fyrir seinni
heimstyrjöldina var engin flúorframleiðsla nauðsynleg
en margt breyttist þegar byrjað var að byggja
kjarnorkuvopn. Nú er flúor framleitt og flutt
á milli staða í tonnatali. Einnig er flúor
notað við uraníumframleiðslu og yfir hundrað
aðrar tegundir efna, t.d margar tegundir af harðplasti
líkt og Teflon. Auðvitað er flúor til
í mörgum myndum og í glergerð er flúorsýra
notuð. Hún kemur t.d. að góðum notum
við gerð ljósapera. Í sumum löndum
er flúori bætt í drykkjarvatnið til
að minnka líkur á tannskemmdum og svo þekkja
allir flúortannkremin og munnskolin.
Höfundur:
Elísabet Ósk Þormar,
NÁT 123.
|